Para as mulleres en idade reprodutiva con epilepsia, a seguridade dos fármacos anticonvulsivos é fundamental para elas e para a súa descendencia, xa que a medicación adoita ser necesaria durante o embarazo e a lactación para reducir os efectos das convulsións. É unha preocupación saber se o tratamento con fármacos antiepilépticos maternos durante o embarazo afecta o desenvolvemento dos órganos fetais. Estudos anteriores suxeriron que, entre os fármacos anticonvulsivos tradicionais, o ácido valproico, o fenobarbital e a carbamazepina poden presentar riscos teratoxénicos. Entre os novos fármacos anticonvulsivos, a lamotrixina considérase relativamente segura para o feto, mentres que o topiramato pode aumentar o risco de fenda labio-palatina fetal.
Varios estudos de neurodesenvolvemento demostraron unha asociación entre o uso materno de ácido valproico durante o embarazo e a diminución da función cognitiva, o autismo e o trastorno por déficit de atención con hiperactividade (TDAH) na descendencia. Non obstante, as evidencias de alta calidade sobre a relación entre o uso materno de topiramato durante o embarazo e o neurodesenvolvemento da descendencia seguen sendo insuficientes. Afortunadamente, un novo estudo publicado a semana pasada no New England Journal of Medicine (NEJM) ofrécenos aínda máis evidencias.
No mundo real, non é posible realizar ensaios controlados aleatorios a grande escala en mulleres embarazadas con epilepsia que necesitan anticonvulsivos para investigar a seguridade dos fármacos. Como resultado, os rexistros de embarazo, os estudos de cohorte e os estudos de casos e controis convertéronse nos deseños de estudo máis utilizados. Desde un punto de vista metodolóxico, este estudo é un dos estudos de alta calidade que se poden implementar na actualidade. Os seus puntos destacados son os seguintes: adóptase o método de estudo de cohorte de mostra grande baseado na poboación. Aínda que o deseño é retrospectivo, os datos proceden de dúas grandes bases de datos nacionais dos sistemas Medicaid e Medicare dos Estados Unidos que xa foron inscritos anteriormente, polo que a fiabilidade dos datos é alta; o tempo medio de seguimento foi de 2 anos, o que basicamente cumpriu o tempo necesario para o diagnóstico do autismo, e case o 10 % (máis de 400.000 casos en total) foron seguidos durante máis de 8 anos.
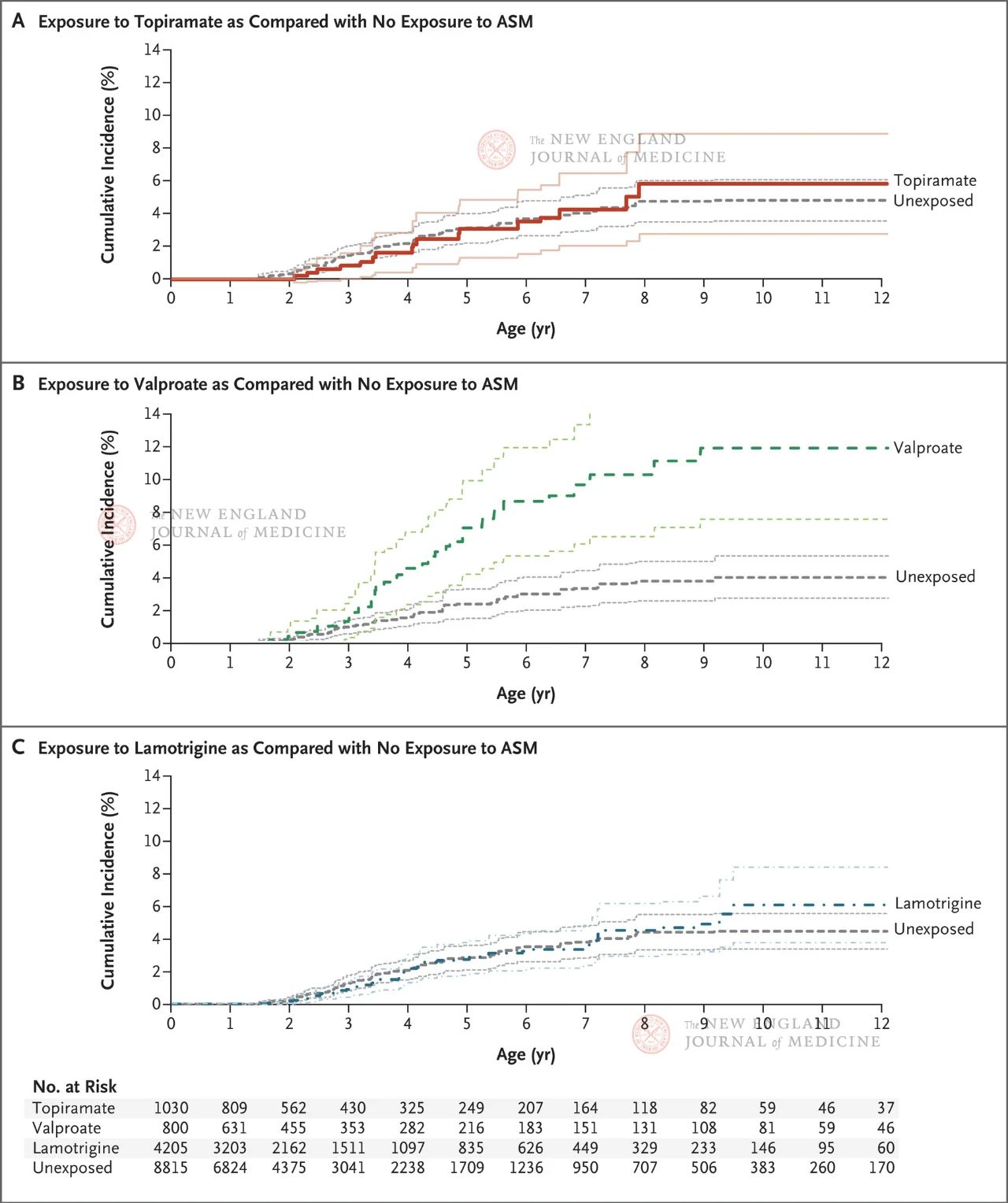
O estudo incluíu a máis de 4 millóns de mulleres embarazadas elixibles, das cales 28.952 foron diagnosticadas con epilepsia. As mulleres agrupáronse segundo se estaban a tomar fármacos antiepilépticos ou diferentes fármacos antiepilépticos despois das 19 semanas de xestación (a etapa na que as sinapses continúan a formarse). O topiramato estaba no grupo exposto, o ácido valproico no grupo de control positivo e a lamotrixina no grupo de control negativo. O grupo de control non exposto incluíu a todas as mulleres embarazadas que non estaban a tomar ningún medicamento anticonvulsivo desde 90 días antes da súa última menstruación ata o momento do parto (incluíndo tamén a epilepsia inactiva ou non tratada).
Os resultados mostraron que a incidencia acumulada estimada de autismo aos 8 anos foi do 1,89 % entre toda a proxenie non exposta a ningún fármaco antiepiléptico; entre as crías de nais epilépticas, a incidencia acumulada de autismo foi do 4,21 % (IC do 95 %, 3,27-5,16) en nenos que non estiveron expostos a fármacos antiepilépticos. A incidencia acumulada de autismo na descendencia exposta a topiramato, valproato ou lamotrixina foi do 6,15 % (IC do 95 %, 2,98-9,13), 10,51 % (IC do 95 %, 6,78-14,24) e 4,08 % (IC do 95 %, 2,75-5,41), respectivamente.
En comparación cos fetos non expostos a fármacos anticonvulsivos, o risco de autismo axustado polas puntuacións de propensión foi o seguinte: foi de 0,96 (IC do 95 %, 0,56~1,65) no grupo de exposición ao topiramato, de 2,67 (IC do 95 %, 1,69~4,20) no grupo de exposición ao ácido valproico e de 1,00 (IC do 95 %, 0,69~1,46) no grupo de exposición á lamotrixina. Nunha análise de subgrupos, os autores chegaron a conclusións similares baseándose en se as pacientes recibiron monoterapia, a dose da terapia farmacolóxica e se houbo exposición relacionada aos fármacos ao comezo do embarazo.
Os resultados mostraron que a descendencia de mulleres embarazadas con epilepsia tiña un maior risco de autismo (4,21 por cento). Nin o topiramato nin a lamotrixina aumentaron o risco de autismo na descendencia de nais que tomaron anticonvulsivos durante o embarazo; Non obstante, cando se tomou ácido valproico durante o embarazo, houbo un aumento do risco de autismo dependente da dose na descendencia. Aínda que o estudo só se centrou na incidencia de autismo na descendencia de mulleres embarazadas que tomaban anticonvulsivos e non abarcou outros resultados neurodesenvolvemento comúns como o declive cognitivo na descendencia e o TDAH, aínda reflicte a neurotoxicidade relativamente débil do topiramato na descendencia en comparación co valproato.
O topiramato xeralmente non se considera un substituto favorable do valproato sódico durante o embarazo, porque pode aumentar o risco de labio leporino e padal fendido e de pequeno tamaño para a idade gestacional. Ademais, hai estudos que suxiren que o topiramato pode aumentar o risco de trastornos do neurodesenvolvemento na descendencia. Non obstante, o estudo do NEJM demostra que, se só se considera o efecto no neurodesenvolvemento da descendencia, para as mulleres embarazadas que necesitan usar valproato para convulsións antiepilépticas, é necesario aumentar o risco de trastornos do neurodesenvolvemento na descendencia. O topiramato pódese usar como medicina alternativa. Cómpre sinalar que a proporción de persoas asiáticas e doutras illas do Pacífico en toda a cohorte é moi baixa, representando só o 1 % de toda a cohorte, e pode haber diferenzas raciais nas reaccións adversas aos fármacos anticonvulsivos, polo que se os resultados deste estudo poden estenderse directamente ás persoas asiáticas (incluídas as chinesas) debe ser confirmado por máis resultados de investigación de persoas asiáticas no futuro.
Data de publicación: 30 de marzo de 2024